3.6 Penentuan Rumus Empiris melalui Eksperimen;[kembali}
Rumus empiris
adalah rumus yang menyatakan tentang perbandingan terkecil atom-atom dari
unsur-unsur yang menyusun suatu senyawa kimia. Rumus ini menyataka perbandingan
jenis dan jumlah paling sederhana dari suatu senyawa.
Sebagai
contoh spesifik, mari kita perhatikan senyawa etanol. Ketika etanol dibakar
dalam perangkat alat seperti yang ditunjukkan pada gambar 1, karbon dioksida
(CO₂) dan air (H₂O) dilepaskan. Karena tidak ada
karbon maupun hidrogen dalam gas masukan, maka dapat disimpulkan bahwa baik
karbon (C) dan hidrogen (H) ada dalam etanol dan oksigen (O) juga dapat ada
dalam etanol. (Molekul oksigen ditambahkan dalam proses pembakaran, tetapi
beberapa oksigen mungkin juga berasal dari sampel etanol.)
Massa CO₂ dan H₂O yang dihasilkan dapat ditentukan dengan mengukur peningkatan massa dari masing-masing absorber CO₂ dan H₂O. Misalkan dalam satu percobaan pembakaran 11,5 g etanol menghasilkan 22,0 g CO₂ dan 13,5 g H₂O. Kita dapat menghitung massa karbon dan hidrogen dalam 11,5 g sampel etanol sebagai berikut:
Dengan demikian, 11,5 g etanol mengandung 6,00 g karbon dan 1,51 g hidrogen. Sisanya harus oksigen, yaitu
massa O = massa sampel - (massa C + massa H)
= 11,5 g - (6,00 g + 1,51 g) = 4,00 g O
Jumlah mol setiap unsur dalam 11,5 gram sampel etanol adalah
Oleh karena itu, rumus etanol C₀,₅₀H₁,₅O₀,₂₅ (kita membulatkan jumlah mol menjadi dua angka penting). Karena jumlah atom harus berupa bilangan bulat, kita membagi subskrip dengan subskrip terkecil 0,25 dan memperoleh rumus empiris C₂H₆O.
PENENTUAN RUMUS MOLEKUL
Rumus molekul dari suatu senyawa menunjukkan jumlah atom sebenarnya dari masing-masing unsur dalam satu molekul senyawa tersebut. Rumus moekul dapat diartikan sebagai kelipatan dari rumus empirisnya.
Rumus molekul menyatakan atom-atom penyusun suatu senyawa lengkap dengan jumlahnya dalam satu molekul yang ditulis mengikuti kaidah tertentu, seperti aturan penulisan senyawa organik, senyawa ion, senyawa kompleks, dan lain-lain.
Sebagai contoh senyawa etanol, etanol merupakan nama senyawanya. Rumus molekul etanol yaitu C2H5OH sedangkan rumus empirisnya yaitu C2H6O.
Contoh lainnya yaitu benzena, memiliki rumus molekul C6H6, sedangkan rumus empirisnya adalah CH.
Beberapa contoh lainnya dapat dilihat pada tabel berikut.
|
Nama Senyawa |
Rumus Molekul |
Rumus Empiris |
n (faktor perkalian) |
|
Glukosa |
C6H12O6 |
CH2O |
6 |
|
Asam oksalat |
C2H2O4 |
CHO2 |
2 |
|
Asam format |
CH2O2 |
CH2O2 |
1 |
|
Isooktana |
C8H18 |
C4H9 |
2 |
|
Hidrogen peroksida |
H2O2 |
HO |
2 |
langkah – langkah menentukan rumus empiris dan rumus molekul suatu senyawa:
- Menghitung perbandingan massa unsur
- Menghitung perbandingan mol
- Menghitung perbandingan jumlah atom
- Menentukan rumus empiris
- Menentukan rumus molekul
3.7 Reaksi Kimia dan Persamaan Kimia;[kembali}
Hal-hal yang digambarkan dalam persamaan reaksi adalah rumus kimia zat-zat pereaksi (reaktan) di sebelah kiri anak panah dan zat-zat hasil reaksi (produk) di sebelah kanan anak panah. Anak panah dibaca yang artinya “membentuk” atau “bereaksi menjadi”. Wujud atau keadaan zat-zat pereaksi dan hasil reaksi ada empat macam, yaitu gas (g), cairan (liquid atau l), zat padat (solid atau s) dan larutan (aqueous atau aq). Bilangan yang mendahului rumus kimia zat-zat dalam persamaan reaksi disebut koefisien reaksi. Koefisien reaksi diberikan untuk menyetarakan atom-atom sebelum dan sesudah reaksi. Selain untuk menyetarakan persamaan reaksi, koefisien reaksi menyatakan perbandingan paling sederhana dari partikel zat yang terlibat dalam reaksi.
Pereaksi atau reaktan Hasil reaksi/produk
2 H₂ + O₂ → 2 H₂O
koefisien H2 = 2 koefisien O2 = 1 koefisien H2O = 2
Berdasarkan persamaan reaksi di atas, berarti 2 molekul hidrogen bereaksi dengan 1 molekul oksigen membentuk 2 molekul H2O. Oleh karena itu sebaiknya dihindari koefisien pecahan karena dapat memberi pengertian seolaholah partikel materi (atom atau molekul) dapat dipecah.
Kita mengetahui massa satu mol dari masing-masing zat ini, sehingga kita juga dapat menafsirkan persamaan kimia sebagai berikut: "4,04 g H₂ bereaksi dengan 32,00 g O₂ menghasilkan 36,04 g H₂O."
Penafsiran Persamaan Kimia terlihat pada tabel berikut:
2H₂ | + O₂ | → | 2H₂O |
Dua molekul | Satu molekul | → | Dua molekul |
2 mol | 1 mol | → | 2 mol |
2(2,02 g) = 4,04 g | 32,00 g | → | 2(18,02 g) = 36,04 g |
36,04 g reaktan | 36,04 g produk | ||
MENYETARAKAN PERSAMAAN KIMIA
Reaksi dikatakan setara jika atom dari unsur-unsur yang bereaksi (ruas kiri) dan hasil reaksi (ruas kanan) telah memiliki jumlah yang sama.
Secara umum, kita dapat menyetarakan persamaan kimia dengan langkah-langkah berikut:
- Identifikasi semua reaktan dan produk dan tuliskan rumus kimia yang benar di sisi kiri dan sisi kanan tanda panah.
- Mulailah menyetarakan persamaan dengan mencoba koefesien yang berbeda untuk membuat jumlah atom dari setiap unsur sama pada kedua sisi tanda panah. Kita dapat mengubah koefisien (angka yang didepan rumus kimia) tetapi bukan subskrip (angka indeks bawah dalam rumus kimia). Mengubah subskrip akan mengubah identitas senyawa. Misalnya, 2NO₂ berarti “dua molekul nitrogen dioksida,” tetapi jika kita mengalikan subskrip, kita memiliki N₂O₄, yang merupakan rumus dinitrogen tetraoksida, kedua senyawa ini benar-benar berbeda.
- Pertama-tama, carilah unsur-unsur yang hanya muncul sekali di setiap sisi tanda panah dengan jumlah atom yang sama di setiap sisi: Rumus yang mengandung unsur-unsur ini harus memiliki koefisien yang sama. Oleh karena itu, tidak perlu menyetarakan koefisien unsur-unsur ini pada langkah ini. Selanjutnya, carilah unsur-unsur yang muncul hanya sekali pada setiap sisi tanda panah tetapi dalam jumlah atom yang tidak sama. Setarakan unsur-unsur ini. Akhirnya, unsur-unsur yang setara muncul dalam dua atau lebih rumus kimia pada kedua sisi tanda panah.
- Periksa persamaan setara tersebut untuk memastikan bahwa kita memiliki jumlah total yang sama untuk setiap jenis atom di kedua sisi tanda panah persamaan.
Contoh :
C3H8(g) + O2(g) → CO2(g) + H2O
Sebelum disetarakan, pada persamaan reaksi tersebut terdapat:
Ruas kiri: 3 atom C, 8 atom H, 2 atom O
Ruas kanan : 1 atom C, 2 atom H, 3 atom O
Untuk menyetarakannya, lakukan langkah-langkah berikut:
1. Setarakan jumlah atom C dengan menambahkan angka 3 pada molekul CO2
C3H8(g) + O2(g) → 3CO2(g) + H2O
Dengan demikian kita mendapatkan jumlah atom C di ruas kiri sama dengan di ruas kanan yaitu sebanyak 3 buah.
2. Setarakan jumlah atom H dengan menambahkan angka 4 pada molekul H2O
C3H8(g) + O2(g) → 3CO2(g) + 4H2O
Dengan demikian kita mendapatkan jumlah atom H di ruas kiri sama dengan di ruas kanan yaitu sebanyak 8 buah.
3. Setarakan jumlah atom O dengan menambahkan angka 5 pada molekul O2
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O
Dengan demikian kita mendapatkan jumlah atom O di ruas kiri sama dengan ruas kanan yaitu sebanyak 10 buah.
Karena jumlah atom di ruas kiri sama dengan di ruas kanan, dikatakan reaksi sudah setara.
Kita menggunakan satuan mol untuk menghitung jumlah produk yang yang terbentuk dalam reaksi kimia. Pendekatan ini disebut metode mol, yang berarti bahwa koefisien stoikiometri dalam persamaan kimia dapat diartikan sebagai jumlah mol dari setiap zat.
Contoh : pembakaran karbon monoksida di udara menghasilkan karbon dioksida.
2CO(g) + O2(g) → 2CO2(g)
Persamaan dia atas dibaca : “2 mol gas karbon monoksida bergabung dengan 1 mol gas oksigen membentuk 2 mol gas karbon dioksida”.
Tahap-tahap metode mol:

- Tuliskan persamaan kimia yang setara untuk reaksi.
- Konversi jumlah reaktan yang diberikan (dalam satuan gram atau satuan lainnya) ke jumlah mol.
- Gunakan rasio mol dari persamaan setara untuk menghitung jumlah mol produk yang terbentuk.
- Konversi mol produk menjadi gram (atau satuan lainnya) produk.
Pada setiaap reaksi tidak selalu massa zat-zat reaktan (zat yang bereaksi) akan habis seluruhnya menjadi hasil atau produk reaksi. Terkadang salah satu dari zat yang bereaksi akan tersisa karena tidak habis bereaksi.
Konsep ini dapat dianalogikan seperti membuat kue. Ketika kita ingin membuat kue untuk 10 orang, ada bahan yang habis terpakai dan ada juga bahan yang tidak habis terpakai.
Pereaksi pembatas adalah reaktan yang benar-benar habis dan menentukan kapan reaksi berhenti.
Cara menemukan pereaksi pembatas :
1. Setarakan reaksi (koefisien-koefisien dalam reaksi setara)
2. Tentukan jumlah mol dari masing – masing reaktan
3. Sesuaikan ke mol hasil reaksi menggunakan perbandingan koefisien kemudia kalikan dengan massa molekul reatifnya
4. Yang menghasilkan gram hasil reaksi paling sedikit itulah pereaksi pembatas.
CONTOH :

Jumlah pereaksi pembatas yang ada pada awal reaksi menentukan hasil teoritis (yield teoritis) dari reaksi, yaitu jumlah produk yang akan dihasilkan jika semua pereaksi pembatas habis bereaksi. Jadi, yield teoritis adalah yield maksimum yang dapat diperoleh, yang diprediksi dari persamaan kimia yang setara. Dalam prakteknya, yield sebenarnya (yield aktual) atau jumlah produk yang sebenarnya diperoleh dari suatu reaksi, hampir selalu kurang dari yield teoritis. Ada banyak alasan untuk perbedaan antara yield aktual dan yield teoritis. Misalnya, kebanyakan reaksi bersifat reversibel, sehingga tidak berjalan 100 persen dari kiri ke kanan. Bahkan ketika reaksi 100 persen selesai, mungkin sulit untuk mendapatkan semua produk dari media reaksi (katakanlah, dari larutan dalam air). Beberapa reaksi bersifat kompleks dalam arti bahwa produk yang terbentuk dapat bereaksi lebih lanjut di antara mereka sendiri atau dengan reaktan membentuk produk lain. Reaksi tambahan ini akan mengurangi yield reaksi pertama.
Untuk menentukan seberapa efisien suatu reaksi yang diberikan, para ahli kimia sering mencari persen yield (% yield), yang menggambarkan proporsi yield aktual terhadap yield teoretis. Persen yield dihitung sebagai berikut:
Persen yield (% yield) dapat berkisar antara kurang dari 1 persen hingga 100 persen. Para ahli kimia berusaha untuk memaksimalkan persen yield dalam suatu reaksi. Faktor-faktor yang dapat mempengaruhi persen yield (% yield) termasuk suhu dan tekanan.






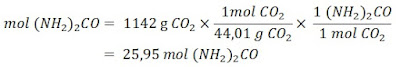


Tidak ada komentar:
Posting Komentar