Buatlah 2 soal (per chapter) pilihan ganda dari tugas kelompok lain (chapter 1 s/d 12 (selain chapter anda))
CHAPTER 1
1. Gas mempunyai sifat mudah dimampatkan dibandingkan zat padat atau zat cair. Hal ini disebabkan karena ….
a. gaya kohesi gas lemah
b. jarak antar molekul gas berjauhan
c. gas tidak dapat dilihat
d. jarak antar molekul gas berdekatan
2. Kecepatan rambat cahaya di ruang vakum adalah 300.000.000 m/s. Dalam bentuk notasi ilmiah, nilai ini sama dengan… .
- 0,3×109 m/s
- 3×108 m/s
- 30×107 m/s
- 300×106 m/s
- 3000×105 m/s
PEMBAHASAN
Jawaban A hingga E semua benar jika dilihat dari nilainya. Tapi berdasarkan aturan yang dipelajari, jawaban yang tepat adalah B karena nilai
CHAPTER 2
1. Pada isotop unsur
jumlah proton dan netron kedua unsur secara berturut – turut adalah . . .
a. (26 , 26) : (88 , 88)
b. (26 , 26) : (88 , 138)
c. (26 , 30) : (88 , 138)
d. (26 , 30) : (88 , 266)
e. (26 , 56) : (88 , 138)
Pembahasan :
- X = lambang unsur
- Z = jumlah proton
- N = nomor atom
- M = massa atom
- Neutron = A – Z
2. Apabila ion Mg+2 bertemu dengan ion Cl; maka akan terbentuk senyawa dengan rumus…
a. MgCl
b. Mg2Cl
c. MgCl2
d. Mg3Cl2
e. Mg2Cl3
Pembahasan
Satu atom Mg (2+) dapat melepas 2 elektron, sementara satu atom Cl (-1) hanya dapat menerima 1 elektron dari luar untuk mencapai konfigurasi gas mulia (Ne= 8 elektron pada kulit terluar).
Jika atom Mg berikatan dengan atom Cl, dibutuhkan 2 atom Cl agar dapat menerima 2 elektron dari Mg.
CHAPTER 4
1. Besarnya pH larutan 0,74 gram Ca(OH)2 (Ar Ca = 40, O = 16, dan H = 1) dalam
500 mL larutan adalah … .
A. 2 – log 4 D. 12 – log 4
B. 2 + log 4 E. 12 + log 4
C. 11 + log 4
Jawaban : E
Pembahasan :
Dik : massa Ca( OH )2 = 0,74 gram
V Ca( OH )2 = 500 mL
(Ar Ca = 40, O = 16, dan H = 1)
Dit : pH = ...?
Dijawab :
M Ca(OH)2 = massa/mr x 1000/v
M Ca(OH)2 = 0,74/74 x 1000/500 = 0,02 M
Ca(OH)2 ==> Ca2+ + 2OH-
0,02M 0,02M 0,04M
pOH = -log[OH-]
= -log 0,04
= 2-log 4
pH = 14-(2-log 4)
= 12+log 4
2. Konsentrasi larutan asam formiat HCOOH 4,6% massa dengan massa jenis 1,01 g/mL adalah (Mr CHOOH = 46)…
A. 1,0100 M D. 1,0000 M
B. 0,1001 M E. 0,0100 M
C. 0,010 M
Jawaban : A
Pembahasan :
Karena massa jenis larutan = 1,01 gram/mL, maka 1 mL larutan = 1,01 gram massanya.
HCOOH yang terdapat dalam larutan = 4,6 x 1,01 = 0,0464 gram
Molaritas = 0,0464 x 1000 = 1,01 M
1. Ruang tertutup yang volumenya 0,2 m3 berisi gas dengan tekanan 60.000 Pa. Berapakah volume gas jika tekanannya dijadikan 80.000 Pa?
a. 0,15 m3
b. 15 m3
c. 0,25 m3
d. 0,10 m3
e. 0,5 m3
Pembahasan:
Diketahui:
P1 = 60.000 Pa
P2 = 80.000 Pa
V1 = 0,2 m3
Ditanyakan: V2 = …?
Jawaban:
P1 . V1 = P2 . V2
60.000 Pa . 0,2 m3 = 80.000 Pa . V2
V2 = 1,2 m3/8
V2 = 0,15 m3
2. Sebanyak 3 liter gas Argon bersuhu 27°C pada tekanan 1 atm( 1 atm = 105 Pa) berada di dalam tabung. Jika konstanta gas umum R = 8,314 J mol−1 K−1 dan banyaknya partikel dalam 1 mol gas 6,02 x 1023 partikel, maka banyak partikel gas Argon dalam tabung tersebut adalah…..
A. 0,83 x 10²³ partikel
B. 0,72 x 10²³ partikel
C. 0,42 x 10²³ partikel
D. 0,22 x 10²³ partikel
E. 0,12 x 10²³ partikel
Pembahasan:
CHAPTER 6
1. Data energi ikatan :
- C = C = 611 kJ/mol
- C – H = 414 kJ/mol
- H – Cl = 431 kJ/mol
- C – Cl = 339 kJ/mol
- C – C = 347 kJ/mol
Berdasarkan data energi ikatan, maka perubahan entalpi pada reaksi C2H4 + HCl → C2H5Cl adalah…kJ.
a. +46
b. -46
c. -58
d. -138
e. -148
Jawaban : C
Pembahasan :
Struktur ikatan :
Maka :
ΔH reaksi = energi pemutusan ikatan – energi pembentukan ikatan
= ( 2.698 – 2.756) kJ/mol
= -58 kJ/mol
Energi ikatan C=O, H=O, dan O=O berturut-turut adalah 243 kJ/mol, 432 kJ/mol, dan 335 kJ/mol. Energi ikatan rata-rata C – H adalah….
a. 194,75 kJ/mol
b. 358,75 kJ/mol
c. 804,5 kJ/mol
d. 595,00 kJ/mol
e. 599,50 kJ/mol
Pembahasan :
Jawaban : B
CHAPTER 7
1. Unsur X mempunyai 10 proton dan 12 neutron, sedangkan unsur Y mempunyai nomor massa 23 dan nomor atom 11. Kedua atom tersebut merupakan . . . .
A. Isotop
B. Isobar
C. Isoton
D. Isokhor
E. Isomer
Jawaban : C
Pembahasan :
Pertama kilat dulu penertian dari istilah diatas
- Isotop = Atom sama, Nomor Atom sama, Nomor Massa Berbeda
- Isobar = Atom berbeda, Nomor Atom Berbeda, Nomor Massa sama
- Isoton = Atom berbeda, Nomor atom dan nomor massa berbeda, jumlah neutron sama
- Isokhor = istilah dalam termodinamika jika volume system tetap
- Isomer = senyawa yang memiliki rumus molekul sama tetapi rumus struktur, gugus fungsi dan geometri berbeda.
2.Atom X dan Y memiliki jumlah neutron yang sama maka X dan Y adalah isotonOption C dan D tidak ada hubungannya dengan soal.
Atom X memiliki :
p = 10
n = 12
Nomor atom = jumlah proton = 10
Nomor massa = p + n = 10 + 12 = 22
Atom Y memiliki :
Nomor massa = 23
Nomor atom = 11 = jumlah proton
Jumlah neutron =Nomor massa – p
= 23 – 11 = 12
Electron terakhir dari atom X memiliki empat bilangan kuantum sebagai berikut :
n = 4, l = 0, m = 0 , s = + ½
Nomor atom X adalah . . . .
A. 19
B. 20
C. 28
D. 37
E. 45
Jawaban : A
Pembahasan
n = 4 , kulit ke empat
l = 0 , sub kulit s
m = 0, orbital s hanya memiliki satu nilai m
s = + ½ , arah panah ke atas
Orbital yang dimaksud adalah = 4s1
Konfigurasi elektronnya : 1s2 2s2 2p6 3s2 3p6 4s1
Nomor atom = 19
CHAPTER 8
1. Jika tingkat keasaman dan kebasaan senyawa hidroksida unsur-unsur periode ketiga dibandingkan, maka…
a. Cl(OH)7 bersifat asam yang lebih kuat dari S(OH)6
b. Si(OH)4 bersifat asam yang lebih lemah dari Al(OH)3
c. P(OH)5 bersifat asam yang lebih kuat dari S(OH)6
d. Si(OH)4 bersifat basa yang lebih kuat dari Al(OH)3
e. Mg(OH)2 bersifat basa yang lebih lemah dari Al(OH)3
Pembahasan :
Dalam periode ketiga dari kiri ke kanan, sifat keasaman makin bertambah dan sifat kebasaan makin berkurang.
Jawaban : A
2. Senyawa hidroksida unsur periode ketiga yang terionisasi menurut tipe : MOH → M+ + OH– adalah…
a. Si(OH)4
b. P(OH)5
c. Mg(OH)2
d. Cl(OH)7
e. S(OH)6
Pembahasan
Senyawa hidroksida bersifat basa jika senyawa tersebut dapat melepas ion OH– . Hal ini berlaku untuk M dengan energi ionisasi kecil.
M akan mudah melepas elektron menjadi bermuatan parisal positif, dan elektron tersebut akan diterima oleh atom O yang akan menjadi bermuatan parsial negatid.
Ikatan yang terbentuk antara M dan O merupakan ikatan ionik, yang dapat melepas ion OH–
dari keterangan kita ketahui bahwa yang memiliki ikatan ion adalah Mg(OH)2
Jawaban : C
CHAPTER 9
1. Dua buah unsur memiliki notasi 11X dan 17Y. Bila kedua unsur tersebut berikatan maka senyawa yang dihasilkan adalah ….
a. XY2
b. XY3
c. X2Y
d. X2Y2
e. X2Y
Jawaban: B
Pembahasan:
Pada ikatan kimia untuk membentuk suatu senyawa harus ada ikatan yang mana adanya gaya tarik-menarik listrik antara ion yang berbeda muatan yang biasa disebut ikatan ion.
13X= 2 8 3 (golongan IIIA) membentuk ion X3+
17Y= 2 8 7 (golongan VIIA) membentuk ion Y–17Y= 2 8 7 (golongan VIIA) membentuk ion Y–
Sehingga membentuk dengan senyawa XY3
2. Diantara senyawa berikut yang bukan molekul kovalen polar adalah?
a. HCl
b. NACl
c. NH3
d. H20
e. PCl3
Jawaban : B
Pembahasan:
Molekul
Penyusun
Ikatan
Keterengan
HCl
Semua non logam
Kovalen
2 atom tidak sejenis= Polar
NACl
Na= logam
Ion
–
NH3
Semua non logam
Kovalen
Punya 1 PEB= Polar
H2O
Semua non logam
Kovalen
Punya 2 PEB= Polar
PCl3
Semua non logam
Kovalen
Punya 1 PEB= Polar
CHAPTER 10
1. CH4 mempunyai struktur tetrahedral, dengan empat buah domain elektron ikatan pada empat arah yang sama. Maka bentuk hibridisasi yang terjadi pada CH4 adalah ….
A. sp
B. sp3
C. sp3d2
D. sp2
Jawaban: B
Penyelesaiannya:
Konfigurasi elektron atom 6C = 1s2 2s2 sp2
2. Empat elektron yang tidak berpasangan pada konfigurasi elektron C terhibridisasi akan berpasangan dengan elektron dari atom H sehingga membentuk orbital hibrid sp3 (tetrahedral).
Bentuk molekul bipiramida trigonal memiliki orbital hibrida ….
A. sp
B. sp2
C. sp3
D. sp3d
E. sp3d2
Jawaban: D
Penyelesaiannya:
Bentuk molekul berdasarkan teori hibridisasi dapat kita lihat dalam tabel bentuk molekul berikut.
Jenis Orbital
Orbital Hibrida
Bentuk Molekul
Contoh
s dan p
sp
Linear
BeCl2
s dan p
sp2
Segitiga planar
BF3
s dan p
sp3
Tetrahedral
CH4
s, p, dan d
sp3d
Bipiramida trigonal
PCl5
s, p, dan d
sp3d2
Oktahedral
SF6
CHAPTER 11
1. 1. Ketika NaCl larut dalam air, menghasilkan Na+ dan Cl– sebagai larutan. Gaya tarik menarik yang terjadi antara Na+ dan air disebut interaksi.....
- dipol-dipol
- ion-ion
- ikatan hidrogen
- ion-dipol
- gaya dispersi.
2. Berdasar data berikut manakah yang mengindikasikan memiliki gaya interaksi terkuat?
Zat
ΔHvap (kJ/mol)
Argon (Ar)
6,3
Benzena (C6H6)
31,0
Etanol (C2H5OH)
39,3
Air (H2O)
40,8
Metana (CH4)
9,2
A. Argon
B. Benzena
C. Etanol
D. Air
E.Metana
Menguap sama artinya mengubah partikel cair menjadi gas. Untuk menjadi gas dari cairan maka partikel-partikel yang berinteraksi harus memisahkan diri. Energi penguapan (∆Hvaporation) menunjukkan besar energi yang diperlukan untuk memutuskan interaksi antarpartikel. Semakin kuat interaksi atau gaya tarik-menarik antarpartikel maka dibutuhkan energi penguapan lebih besar. Jadi gaya interaksi terkuat pada soal ini adalah Air dengan ∆Hvaporation terbesar.
CHAPTER 12
1. Jika didalam zat terlarut dan zat pelarut ada 200 gram air dan dilarutkan 30 gram asam cuka (CH3COOH) fraksi molnya zat terlarut adalah (Ar C = 12, H= 1, O = 16) ….
a. 0,943
b. 0,957
c. 0,987
d. 0,945
e. 0,975
Jawaban : B
Pembahasan :
Mr CH3COOH = 60
M r H2O = 18
2. Tekanan uap pada temperatur 30 adalah 55.30 mmHg. Maka penurunan tekanan uap, jika kedalam 108 gram air dilarutkan 36 gram glukosa Jika (Ar C=12, H=1, O=16) adalah ….
a. 1,66 mmHg
b. 1,33 mmHg
c. 1,45 mmHg
d. 1,48 mmHg
e. 1,56 mmHg
Jawaban : A
Pembahasan :
Karena penurunan tekanan sebanding dengan fraksi mol zat terlarut maka dicari terlebih dahulu fraksi mol zat terlarut.
Mr C6H12O6 = 180
Mr H2O = 18

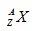












Tidak ada komentar:
Posting Komentar