KUIS 7
CHAPTER 19
Mengapa rangkaian peluruhan radioaktif mengikuti kinetika orde pertama?
Jawab:
Deret peluruhan radioaktif mematuhi kinetika orde satu dan laju peluruhan radioaktif setiap t diberikan.
Nilai pada saat t = λN
Dimana λ laju orde satu konstan dan N adalah jumlah inti radioaktif yang ada pada waktu t. reaksi peluruhan radioaktif bergantung pada hukum kekekalan energi dan momentum.
CHAPTER 20
Gambarkan struktur Lewis untuk klorin nitrat (ClONO2) dan klorin monoksida (ClO).
CHAPTER 21
Tulis persamaan yang seimbang untuk
masing-masing berikut ini reaksi: (a) natrium bereaksi dengan air; (b) larutan
NaOH bereaksi dengan CO2; (c) padat Na2CO3 bereaksi dengan larutan HCl; (d)
NaHCO3 padat bereaksi dengan larutan HCl; (e) NaHCO3 padat adalah dipanaskan;
(f) Na2CO3 padat dipanaskan.
JAWAB:
(a) 2Na(s) + 2H2O(l) ⎯⎯→ 2NaOH(aq) + H2(g)
(b) 2NaOH(aq) + CO2(g) ⎯⎯→ Na2CO3(aq) + H2O(l)
(c) Na2CO3(s) + 2HCl(aq) ⎯⎯→ 2NaCl(aq) + CO2(g) +
H2O(l)
(d) NaHCO3(aq) + HCl(aq) ⎯⎯→ NaCl(aq) + CO2(g) +
H2O(l)
(e) 2NaHCO3(s) ⎯⎯→ Na2CO3(s) + CO2(g) +
H2O(g)
(f) Na2CO3(s) ⎯⎯→tidak terjadi
reaksi,Tidak seperti CaCO3 (s), Na2CO3 (s) tidak terurai dengan pemanasan
sedang
CHAPTER 22
Berapa bilangan oksidasi dari O dan F dalam HFO?
JAWAB :
Pada suasana sedikit basa reaksi
yang terjadi adalah
2HOF
→ 2HF + O2
HOF bereaksi membentuk HF dengan
melepaskan oksigen. Biloks F pada HOF yang paling mungkin adalah +1 karena pada
HF biloks F adalah –1. Sangat tidak mungkin biloks F tidak mengalami perubahan
andai pada HOF biloks F = –1 juga (dalam hal ini biloks F = –1 karena F
elektronegativitasnya paling besar dibanding unsur lain). Berdasarkan biloks F
biloks +1 dan juga H biloksnya +1 maka biloks O padaHOF tadi adalah –2 sebagaimana
biasanya. Pada reaksi tersebut O mengalami oksidasi dari biloks –2 menjadi 0.
Gambaran perhitungan biloks F yang
berharga positif ini dapat dilihat pada struktur Lewis dari HOF berikut. Memang
secara teori F sebenarnya tidak akan mungkin memiliki biloks +1 karena
elektronegativitasnya yang sangat tinggi dibandingkan O. Untuk informasi bahwa nilai elektronegatifitas: F = 3,98; O =
3,44; H = 2,20. Tapi fakta berkata lain bahwa memang ada reaksi HOF
yang dapat terjadi seperti reaksi di atas bahkan disertai dengan menghasilkan
energi yang cukup tinggi.
Pada suasana netral (atau sedikit
asam) reaksi yang terjadi adalah
2HOF
+ H2O → 2HF + H2O2
Reaksi ini adalah reaksi redoks. Serupa dengan reaksi HOF pada suasana sedikit
basa, bilangan oksidasi H pada zat-zat yang terlibat reaksi semuanya
adalah +1 artinya biloks H tidak mengalami perubahan. Otomatis biloks
unsur yang berubah adalah F dan O. F mengalami reaksi reduksi (perubahan biloks
dari +1 menjadi –1) dan O mengalami reaksi oksidasi(perubahan biloks dari –2
menjadi –1).
Pada fakta lain ternyata O pada HOF
dapat mengalami reaksi disproporsionasi sesuai reaksi:
2HOF
→ H2O + OF2
Karena O dapat mengalami
disproporsionasi artinya pada HOF itu O memiliki biloks 0 (nol). Biloks O pada
H2O sangat jelas –2 sedangkan pada OF2 biloks O adalah
+2. Pada HOF biloks H = +1 dan biloks O = 0, oleh karena itu F tentu biloksnya
adalah –1. Penjelasan mengenai biloks F ini dapat dilihat melalui gambar
struktur lewis berikut ini.
Biloks H = elektron valensi H –
elektron di sekitar H, elektron valensi H adalah 1 dan elektron di
sekitar H menjadi tidak ada (0) karena elektronnya direbut oleh O yang
lebih elektronegatif dibanding H. Jadi biloks H = 1 – 0
= +1
Biloks O = elektron valensi O – jumlah elektron yang dapat diraih O, ingat
unsur yang lebih elektronegatif akan lebih kuat menarik elektron yang tadinya
digunakan secara bersama ke atom tersebut, seolah ia menarik sepenuhnya
elektron. Demikian pula untuk F yang berikatan langsung dengan O, karena F
elektronegativitas lebih besar dari O maka elektron yang digunakan berikatan
antara O-F ditarik lebih kuat ke F. Jadi biloks O = 6 –
6 = 0, biloks F = 7 – 8 = –1
Kesimpulan dari ulasan di atas bahwa biloks O dan F pada senyawa HOF tergantung
reaksi yang berlangsung. Kita tidak heran mengapa ini terjadi, sebab bilangan
oksidasi hanyalah upaya imajinatif untuk menjelaskan proses (fakta) yang
terjadi. Kalaupun tidak sesuai teori sebelumnya tentu ini bisa masuk
perkecualian hingga ditemukan cara menjelaskan gejala yang dapat berlaku secara
umum.
CHAPTER 23
Jelaskan istilah-istilah berikut:
(a) enansiomer,
(b) campuran rasemat
JAWAB :
(a) Enansiomer:
Ini adalah stereoisomer yang merupakan bayangan
cermin non-superimposable satu sama lain dan memutar bidang cahaya
terpolarisasi bidang melalui sudut yang sama tetapi berbeda dalam arah yang
berlawanan. Mereka memiliki sifat fisik yang identik (titik lebur, titik didih,
massa jenis, indeks bias, dll) kecuali arah rotasi bidang polarisasi. Tapi
besarnya rotasinya sama. Mereka memiliki sifat kimia yang identik kecuali
terhadap reagen kiral.
Misalnya, asam tartarat d dan asam tartarat l adalah
enansiomer.
(b) Rasemisasi:
Ini adalah proses di mana campuran rasemat diperoleh
dari bahan awal kiral. Ketika jumlah ekuimolar isomer dekstro dan laevo
dicampur, campuran yang dihasilkan ditemukan tidak aktif secara optik karena
kompensasi eksternal. Campuran ini disebut campuran rasemat atau rasemat. Jadi
asam tartarat dl adalah rasemat karena mengandung proporsi isomer d dan l yang
sama.
CHAPTER 24
Gambarkan semua kemungkinan isomer struktural untuk
berikut ini
alkana: C7H16
JAWAB :
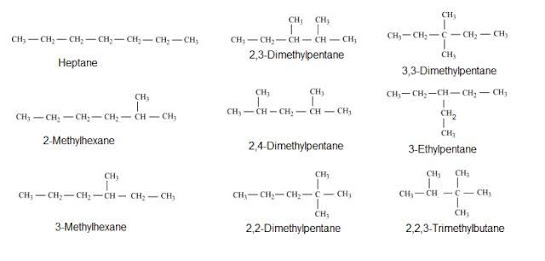
C₇H₁₆ memiliki sembilan isomer,
berikut adalah nama isomernya sesuai sistem penamaan IUPAC:
- n-heptana
- 3-etilpentana
- 2-metilheksana
- 3-metilheksana
- 3,3-dimetilpentana
- 2,4-dimetilpentana
- 2,3-dimetilpentana
- 2,2-dimetilpentana
- 2,2,3-trimetilbutana
CHAPTER 25
Jelaskan pembentukan polistiren
Jawab:
Proses pembuatan polistirena ini dilakukan dengan metode polimerisasi larutan. Proses pembuatannya yaitu dengan cara mereaksikan stirena monomer dengan initiator benzoil peroksida dalam Reaktor Alir Tangki Berpengaduk (RATB) yang dilengkapi dengan jaket pendingin dan berlangsung pada kondisi tekanan 1 atm dan suhu 900C. Selanjutnya, digunakan flash drum bentuk vertikal untuk memisahkan fase uap dan cairan dari hasil keluaran reaktor. Produk polistirena yang keluar sebagai hasil bawah flash drum dimasukkan ke dalam extruder untuk membentuk lelehan polistirena menjadi polistirena berbentuk pellet berukuran 1/8 in; sedangkan, produk atas flash drum akan digunakan kembali sebagai umpan recycle.









Tidak ada komentar:
Posting Komentar